编辑丨王多鱼
排版丨水成文
艾滋病 (AIDS) ,即获得性免疫缺陷综合征,是一种由人类免疫缺陷病毒 (HIV) 感染引起的危害性极大的传染病。 HIV 病毒把人体免疫系统中最重要的 CD4+T 细胞 作为主要攻击目标,大量破坏该细胞,经过数年、甚至长达10年或更长的潜伏期后发展成艾滋病病人,使人体丧失免疫功能,因抵抗力极度下降会出现多种感染,后期常常发生恶性肿瘤,以至全身衰竭而死亡。
在过去的几十年里,何大一等人提出的“鸡尾酒疗法”等联合治疗方案使得艾滋病成为了一种相对可控的慢性疾病,HIV 感染患者的存活时间和生活质量也得到了极大的改善。然而,这些疗法只能抑制患者体内的 HIV 病毒,而不能彻底清除,因此也就无法治愈。
据联合国艾滋病规划署数据,目前全球范围内现存HIV携带者和艾滋病患者人数高达3800万人,且数量仍在快速增长中。
近日,以色列特拉维夫大学的研究人员在 Nature Biotechnology 期刊上发表了题为: In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice 的研究论文。
该研究使用两种腺相关病毒载体 (AAV) 同时递送 CRISPR-Cas9 基因编辑系统和靶向免疫球蛋白基因的修复模板,直接编辑小鼠内源 B 细胞的免疫球蛋白基因位点, 有效地在体内修饰 B 细胞,使之能产生针对 HIV 病毒的中和抗体,让一次性注射治疗艾滋病成为可能。

多年以来,科学家们在治疗 HIV 感染时一直面临一个十分棘手的问题——HIV 在人体中变异迅速,极易产生耐药性。令人兴奋的是,2011年 Michel Nussenzweig 团队在一名 HIV 感染者体内分离出了一种 HIV 广泛中和抗体——3BNC117。
然而,尽管针对 HIV 的强效、广泛中和抗体 (bNAb) 可以保护机体免受感染,但众多的艾滋病候选疫苗的临床试验最终无一不以失败告终,这提示我们想要通过传统的免疫方法实现对 HIV 的免疫是十分困难甚至是不可能的,必须走出新的道路。
对此,如果能通过 CRISPR 技术直接编辑免疫球蛋白基因来重编程体液免疫,使之产生靶向特定病原体 (如HIV病毒) 的中和抗体,那将是一种里程碑式的革新。
在这项最新研究中,研究团队设计了两种重组腺相关病毒 (AAV) :一种编码 CRISPR-Cas9 基因编辑系统,包括 CMV/SFFV 启动子驱动的 SaCas9 和 U6 启动子驱动的 sgRNA;另一种编码靶向免疫球蛋白基因的 HIV-bNAb-3BNC117 同源性定向修复模板 (HDRT) 。
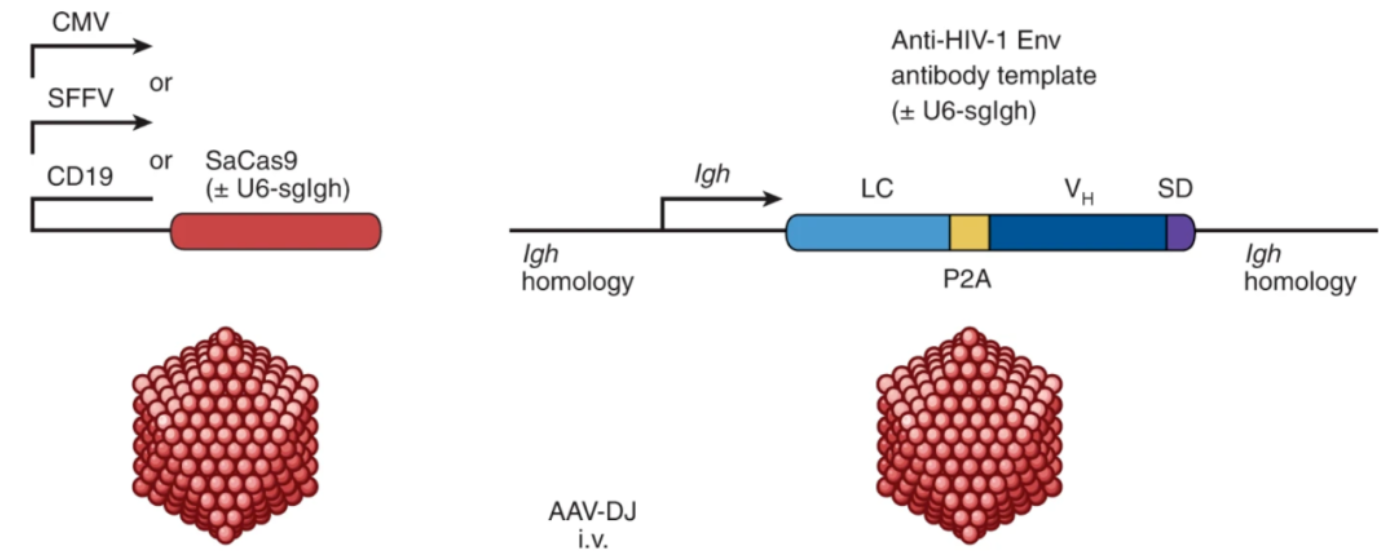
两种重组腺相关病毒递送CRISPR-Cas9基因编辑系统和HDRT
研究人员使用各种 HIV 包膜糖蛋白 (Env) 为基础的免疫原免疫小鼠,以扩大激活细胞的数量,6天后通过静脉注射将这两种重组 AAV 地送到小鼠体内。经过几次相同的 HIV-Env 增强免疫后,小鼠的血清中开始表达广泛中和抗体,并且可以中和 3BNC117 敏感的 HIV 毒株。
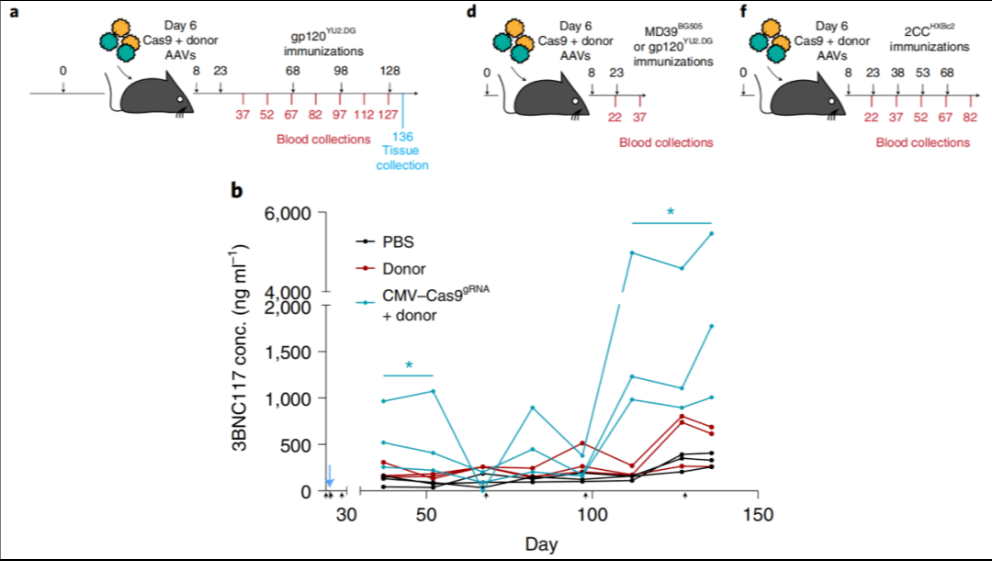
免疫小鼠产生3BNC117
紧接着,研究团队通过高通量测序分析了基因编辑效果。正如预期的那样,早期可在小鼠的肝脏和血液中发现 AAV 基因组的强烈富集,随着时间的推移,在肝脏中 AAV 拷贝数减少,而在免疫小鼠的淋巴结和骨髓中增加,这表明在这些组织中B细胞克隆扩增正在进行。
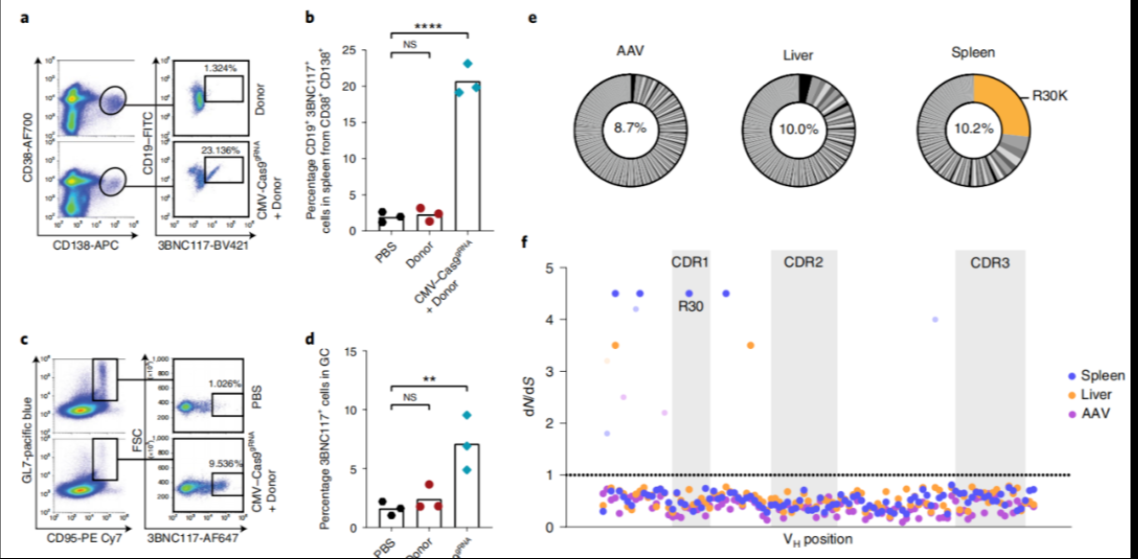
注射AAV后130天,在免疫小鼠的淋巴组织中发现了体内工程B细胞
研究小组还通过 CHANGE-seq 评估了脱靶编辑的程度,结果显示,95%的 Cas9 诱导的切割是靶标特异性的,并且所有主要脱靶编辑位点都位于基因间或内含子区域。
为了防止在在细胞中的脱靶编辑,研究团队等将驱动 Cas9 表达的 CMV/SFFV 启动子替换为B细胞特异性 CD19 启动子。除此之外,他们还将编码 gRNA 的元件转移到含 HDRT 的 AAV 中,这样只有同时转导了两种 AAV 的细胞才能被编辑。这种新设计在保持编辑效率和血清抗体水平的同时,显著降低了肝脏中的 Cas9 表达和非特异性切割。
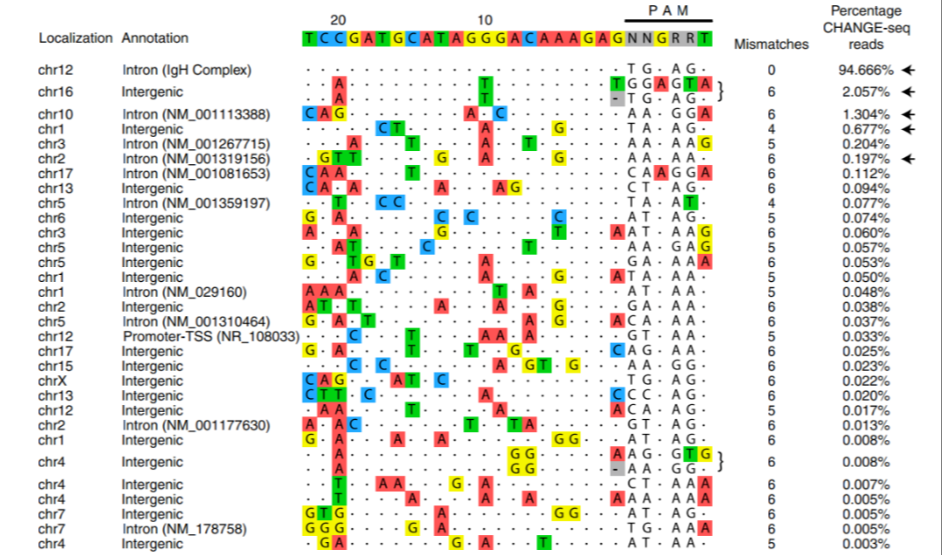
脱靶切割分析显示了较高的安全性
总而言之,这项研究开发了一种实现 HIV 免疫的新方法——通过 CRISPR 技术直接编辑免疫球蛋白基因来重编程体液免疫,诱导免疫系统产生对抗 HIV 的广泛中和抗体——3BNC117,中和 3BNC117 敏感的 HIV 毒株。
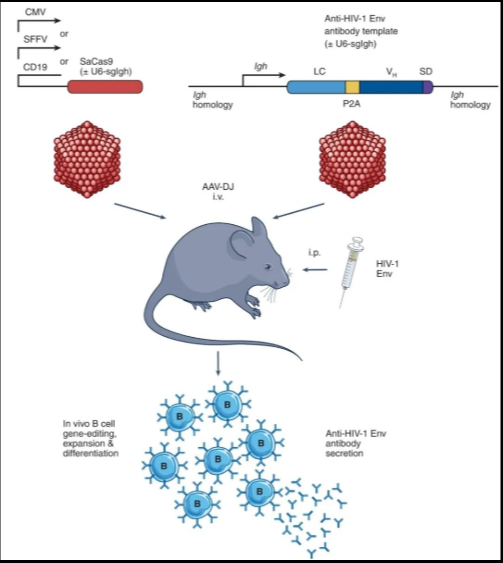
研究模式图
当然,这项技术的实现还存在许多障碍:抗体滴度仍要更高、更稳定才能确保治疗效果和减少免疫接种次数;需要结合多种互补的广泛中和抗体 (bNAbs) 提高对 HIV 的免疫预防;在没有加强免疫的情况下,这些抗体反应是否持续尚不清楚;以及最重要的安全性问题,是否会引起不良免疫反应,是否会导致 AAV 染色体随机整合驱动的致癌事件。
尽管如此,这项研究成果仍是令人兴奋,它表明直接基因编辑B细胞从而产生特异性广泛中和抗体(bNAbs)将成为缺乏有效疫苗的传染性疾病的潜在治疗方案。研究团队表示,预计在未来几年内,将能以这种方式生产治疗艾滋病、其他传染病和某些由病毒引起的癌症 (如宫颈癌、头颈癌) 的药物。
