红枫湾APP:医学界开始批准使用药物和手术来改变人体细胞内的基因密码,并纠正可能会导致癌症和自身免疫疾病等情况的“坏密码”。由于艾滋病也是一种由病毒将坏密码插入基因而导致的疾病,所以基因疗法可以用来剪掉这段密码并产生治愈效果。
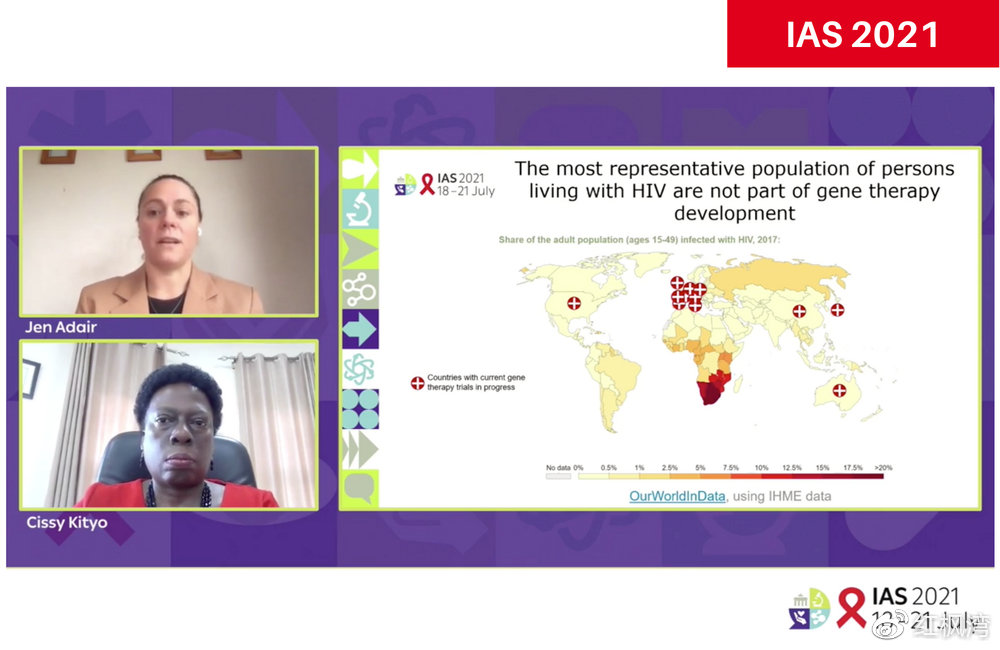
今年国际艾滋病学会科学会议(IAS 2021)上的艾滋病治愈研讨会探讨了基因疗法的话题。研讨会开始时有两段引导性谈话,参与者有美国西雅Fred Hutch癌症研究中心的基因治疗主任Hans-Peter Kiem教授,Jennifer Adair博士,以及乌干达坎帕拉联合临床研究中心(JCRC)的Cissy Kityo博士。
在第二段谈话中,大家承认,虽然遗传医学的前景比以往要好的多,但它们的费用和复杂性与艾滋病的全球流行情况不太匹配,艾滋病毒主要影响世界上最贫穷和最弱势的群体。
所以,Fred Hutch和JCRC已经开始了一个联合研究项目,目标是在未来几年内,开发出一种可以实际在低收入情况下推广使用的艾滋病基因疗法。
艾滋病可以治愈
推动艾滋病治愈研究的一个重要因素是确实有人被治愈:Timothy Ray Brown,他在2008年首次宣布治愈了艾滋病,并在2010年公开了身份,并于2019年死于白血病。Brown也鼓励第二个被治愈的艾滋患者Adam Castillejo公开自己的身份。
Timothy和Castillejo的故事表明,基因疗法可以治愈艾滋病。他们之所以使用基因疗法,是因为他们都是癌症病人,为了治疗癌症做了骨髓移植,且骨髓捐赠者t细胞缺乏CCR5受体基因,而CCR5几乎是艾滋病毒感染的必要条件。
之所以目前被治愈的艾滋患者只有两例,原因有二:
第一,骨髓移植自身就是一个非常危险的过程,它会删除并替换患者的整个免疫系统。
第二,很难找到匹配的骨髓捐赠者,因为只有1%左右缺乏CCR5受体的人可以成为匹配的骨髓捐赠者,缺乏CCR5受体的人又都是北欧血统,这意味着只能是非常非常少的人从这种基因疗法中受益。
如果用不缺乏CCR5的T细胞进行移植,只能暂时达到无法检测病载的水平,但病载在一段时间后还是会恢复。
另一种基因疗法
Timothy和Castillejo的治疗方法是“同种异体”移植,这意味着对抗艾滋病毒的细胞来自另一个人。
更好的方法是“自体”移植,即从艾滋病患者身上提取免疫系统细胞,在实验室培养皿中进行基因改造,使其能够抵抗艾滋病毒,然后再重新植入。
基因治疗的能力并不局限于CCR5缺失。它可以通过剪切粘贴技术(如CRISPR/Cas9)直接修复细胞中有缺陷的基因,而不是让细胞抵抗艾滋病毒。
这种方法已经被尝试用于治疗一些遗传性疾病,如囊胞性纤维症和镰状细胞贫血。鉴于艾滋感染的细胞在某种意义上也存在“缺陷”,即含有本不应该存在的外来DNA,所以也可以接受相同的分子编辑。
早期试验已产生了很有希望的结果,但和许多基因疗法一样,其面临的问题是确保含有DNA的细胞几乎完全被消除。

有一种方法不是从被感染细胞中删除艾滋病毒的DNA,而是通过制造“嵌合抗原受体”(CAR) t细胞,优先杀死细胞本身。
这些t淋巴细胞的基因已经被修改,所以它们往常的受体如CD4或CD8已经被取代,取代它们的受体与被感染细胞和癌细胞所显示的抗原(外来或异常蛋白质)非常协调。
一些CAR细胞疗法已经被批准用于癌症;艾滋病毒的问题在于储层细胞表面没有免疫刺激抗原。这意味着CAR - t细胞必须与PD-1抑制剂等药物一起使用,这些药物可以阻止细胞退回到静止的储存期。该方法在IAS 2021上展示过。
还有一些其他方法可以用于生产疫苗或提供治愈。一种方法是改造b细胞,使其产生广泛中和性抗体。一种“调整”它们来做到这一点的方法也在IAS 2021上讨论过。但如果我们设法生成可以做到这一点的b细胞,我们就可以在理论上直接编辑它们的基因,使其做到同样的事情。
另一种方法是诱导细胞制造病毒抗原或病毒样颗粒,然后免疫系统会对其作出反应。科学家们已经对这项技术进行了20年的研究,辉瑞和莫德纳成功率超过90%的新冠疫苗代表了这项技术的胜利。
这些疫苗不是改变细胞基因组的“基因工程”;相反,它们在细胞中引入一种基因激活产物,当基因被“解读”时,信使RNA就产生了,它被发送到细胞的其他部分,告诉细胞制造蛋白质。
然而,由于艾滋病毒比新冠更多变,免疫原性更低,所以由RNA诱导的疫苗必须看起来更像一个完整的病毒,而不仅仅是由辉瑞和莫德纳疫苗诱导的裸刺突蛋白。
事实证明很难用抗艾滋病毒或敏感细胞来替代所有易感艾滋病毒细胞:虽然“移植”发生了,这意味着自体细胞不会被身体排斥,并能够在一段时间内建立一个种群(在一些动物实验中,替代多达90%的原生免疫细胞),最终,未改变的免疫细胞往往会胜出,因为引入的细胞缺乏补充细胞的深层储存库。
Kiem教授说,科学家一直试图解决这个问题,其方法是只选择并改变造血干细胞(HSCs)。这些在骨髓中发现的罕见且长寿的细胞是免疫系统的补充库。当它们繁殖时,就会分化,产生各种不同功能的免疫细胞:CD4和CD8 t淋巴细胞,产生抗体的b细胞,吞噬病原体的巨噬细胞,树突状细胞,单核细胞,自然杀伤细胞,等等。
从基因上改变造血干细胞,使其能够以这样或那样的方式对抗艾滋病毒,理论上可能会产生持久的、抵抗艾滋病毒的免疫系统,它们可以随时准备产生各种类型的效应细胞。当出现新发艾滋病毒感染时(用作疫苗),或者当艾滋病毒反弹时,当体内有可检测到的病毒时(用作治疗),这种免疫系统就会做好准备。
如果一个拥有嵌合抗原受体改造干细胞的人能够重复治疗中断周期,那么理论上,他们的艾滋病毒储存库就可以慢慢地被清除。
基因疗法的费用
如上所述,尽管遗传医学显示出了治愈的巨大希望,但其技术的复杂性和成本,意味着目前它不太可能让大多数有需要的人受益。
Kiem教授说,目前大约有6000万人可能需要基因治疗。其中绝大多数是艾滋患者(3700万),其余为患有镰状细胞和地中海贫血等血液疾病的患者(2000万),这些疾病也集中在低收入国家。
基因疗法已经获准用于地中海贫血、脊髓性肌肉萎缩、t细胞淋巴瘤和一种早发性失明,但其价格高得吓人。
药物的价格在180万英镑(约1600万人民币)左右。这种价格不仅因为其复杂的制作成本,还因为它们是用于治疗以上提到的罕见疾病,所以市场份额很小。
美国国立卫生研究院(National Institutes of Health)目前正与盖茨基金会(Bill and Melinda Gates foundation)合作,开展一项针对艾滋病毒和镰状细胞贫血的基因疗法项目。
美国Fred Hutch研究中心与乌干达JCRC打算2年内在非洲开始基因疗法的人体试验。如果能成功的话,对非洲经济将会有所推动。
乌干达JCRC的Cissy Kityo博士在IAS 2021上表示,截至2020年,已有373项基因治疗产品的注册试验,其中35项处于III期疗效试验。全球对再生医学(包括基因疗法和相关技术)的预算为199亿美元,比前一年增长了30%。
美国食品和药物管理局预计,基于目前的进展速度和开发途径,到2025年,他们可能要每年批准约100种基因治疗产品。
Kityo博士说,医学的这一分支不再神秘,现在必须采取行动,在最需要的人群中试验基因疗法,并将其转变为人人都负担得起的疗法。
