自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的10月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Science:重大进展!在体外重建HIV复制和整合过程,为开发靶向HIV衣壳的药物奠定基础
doi:10.1126/science.abc8420
在一项新的研究中,来自美国犹他大学医学院和弗吉尼亚大学的研究人员在试管中重现了导致获得性免疫缺陷综合征(AIDS,俗称艾滋病)的HIV(人类免疫缺陷病毒)感染的最初步骤,实现了几十年来的梦想。这样做使得人们能够近距离观察HIV,并能够确定这种病毒在人类宿主体内复制所需的基本成分。相关研究结果发表在2020年10月9日的Science期刊上,论文标题为“Reconstitution and visualization of HIV-1 capsid-dependent replication and integration in vitro”。
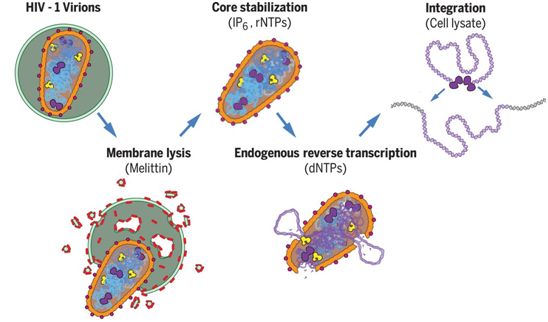
在体外重建和可视化观察HIV-1衣壳依赖性的复制和整合。图片来自Science, 2020, doi:10.1126/science.abc8420。
就HIV的所有危险性而言,这种病毒的外表却很简单。HIV类似于一个圆形的冰淇淋甜筒,它的外壳将它的遗传物质封装在里面。此前,人们一直认为,这个称为衣壳(capsid)的外壳的主要作用是保护它的珍贵货物(即前面提及的遗传物质)。但是,这项新的研究显示,HIV衣壳在感染过程中也发挥着积极作用。
在试管中进行感染的初始步骤,使得这些研究人员能够以以前不可能的方式精确地操纵HIV。他们发现,当他们使用遗传方法和生化方法破坏HIV衣壳的稳定性时,这种病毒无法有效复制它的遗传物质。这是首次直接证明HIV衣壳不仅仅是起着包装的作用,而且也是HIV感染过程本身的一个重要组成部分。
2.JCI:解开谜团!复制性克隆导致一些接受ART治疗的HIV感染者出现持久的病毒血症
doi:10.1172/JCI138099
作为一位深受好评的HIV/AIDS专家,美国匹兹堡大学医学中心传染病主任John Mellors博士越来越多地接受了一位困惑不已的医生的联系,这位医生报告了一些感染HIV病毒的患者坚称自己坚持每天的药物治疗方案旨在控制这种病毒,但是检测结果并非如此。HIV仍然出现在这些患者的血液中,临床医生认为,当用药物控制这种病毒感染时,这种情况是不可能发生的。如今,在一项新的研究中,来自匹兹堡大学医学院的研究人员解开了这个谜团,这一发现具有临床意义。相关研究结果于2020年10月5日发表在Journal of Clinical Investigation期刊上,论文标题为“HIV-1 viremia not suppressible by antiretroviral therapy can originate from large T cell clones producing infectious virus”。
在这项新的研究中,这些研究人员发现,问题不在于不坚持用药,也不在于对药物产生耐药性。相反,这些患者是“复制性克隆(repliclone)”的受害者,复制性克隆指的是大型的可产生传染性病毒颗粒的HIV感染细胞克隆。
Mellors说,“复制性克隆可以长得足够大,并产生足够的病毒,这使得抗逆转录病毒(ART)疗法看起来并不完全有效,即便ART治疗发挥作用,也是如此。”
3.Science:揭示强效HIV抑制剂GS-6207的作用机制
doi:10.1126/science.abb4808
目前的HIV治疗需要必须每天服用药物,如果有一种有效的长效药物,护理工作将得到改善。GS-6207(Lenacapavir)是吉利德科学公司开发的一种药物,显示出6个月给药间隔的潜力,正在进行2/3期临床试验。Bester等人描述了结构和生物物理研究,为GS-6207的强效抗病毒活性提供了基础。HIV的衣壳是圆锥状的,GS-6207能结合两个相邻的衣壳亚基,并让弯曲的衣壳保持稳定。GS-6207还能干扰在病毒感染中起作用的辅助因子对衣壳的结合。对GS-6207活性的这一见解为合理开发改进的长效疗法提供了平台。
4.PLoS Pathog:研究揭示灵长类慢病毒的跨物种传播
doi:10.1371/journal.ppat.1008812
人类持续受到病毒疾病的威胁,例如由埃博拉病毒,寨卡病毒和冠状病毒。此类新出现/重新出现的病毒暴发可能是由野生动物向人类传播的跨物种病毒引起的。为了实现跨物种传播,新宿主必须暴露于旧宿主中的病毒。接下来,病毒获得某些突变,这些突变可能有益于在新宿主中复制。最后,通过在新主机中持续传播,这些病毒可以适应新宿主中的环境。但是,在此过程开始时,病毒必须克服阻碍病毒跨物种传播的“物种壁垒”。包括人类在内的哺乳动物都具有“内在免疫”机制,这种机制在进化上已经分化得足够多,可以为病毒传播建立物种壁垒。

图片来源:Www.pixabay.com。
HIV-1是AIDS的病原体,很可能起源于大约100年前在黑猩猩(SIVcpz)和大猩猩(SIVgor)中发现的相关前体。此外,SIVgor最有可能是通过SIVcpz从黑猩猩到大猩猩的跨物种跳跃而出现的。但是,尚不清楚灵长类慢病毒如何在不同物种之间成功传播。为了限制跨物种的慢病毒传播,包括APOBEC3蛋白在内的细胞“内在免疫”可能会抑制慢病毒复制。相反,在这种进化的“军备竞赛”中的灵长类慢病毒已经获得了自己的“武器”,即病毒感染因子(Vif),以对抗限制因子的抗病毒作用。
东京大学医学科学研究所(IMSUT)的一个研究小组表明,大猩猩APOBEC3G可能在抑制SIVcpz复制中发挥作用。有趣的是,研究小组证明了SIVcpz Vif中的氨基酸取代M16E足以克服大猩猩APOBEC3G介导的限制。“据我们所知,这是第一个报告,表明大猿APOBEC3蛋白可能潜在地限制大猿慢病毒的跨物种传播,以及慢病毒如何克服这种物种障碍。而且,这是首次阐明分子机制的研究。伟大的猿慢病毒可以实现跨物种传播。” IMSUT传染病控制系系统病毒学系副教授Kei Sato说。
5.Lancet HIV:新的临床研究表明当前的HIV治疗方案可导致患者体重增加,特别是女性
doi:10.1016/S2352-3018(20)30241-1
在一项新的称为ADVANCE的临床研究中,来自南非金山大学等研究机构的研究人员研究了治疗HIV感染者的一线抗逆转录病毒(ART)治疗方案的更好选择。这项为期96周的研究的结果近期发表在Lancet HIV期刊上,论文标题为“Dolutegravir with emtricitabine and tenofovir alafenamide or tenofovir disoproxil fumarate versus efavirenz, emtricitabine, and tenofovir disoproxil fumarate for initial treatment of HIV-1 infection (ADVANCE): week 96 results from a randomised, phase 3, non-inferiority trial”。
这项临床研究从约翰内斯堡市希尔布罗内城地区及周边的常规HIV服务机构招募1000多名参与者,分析了目前美国卫生部2019年ART指南中推荐的两种抗逆转录病毒治疗方案,以及高收入国家青睐的第三种治疗方案。
这三种新的治疗方案似乎比老的治疗方案在副作用和耐药性方面有优势,此外还具有潜在的成本优势,但到目前为止,对非洲人群使用这些治疗方案的研究还很少。
所有这三种方案都非常有效,患者对它们的耐受性良好,然而,含有度鲁特韦(dolutegravir, DTG)和替诺福韦艾拉酚胺(tenofovir alafenamide, TAF)的较新治疗方案导致患者的体重大幅增加,尤其是女性患者。
6.eLife:免疫细胞如何控制HIV感染
doi:10.7554/eLife.57246
一项在eLife上发表的最新研究表明,能够识别接受抗逆转录病毒疗法(ART)的HIV感染者(PLWH)体内残留的HIV感染细胞能够保持活跃多年。
研究结果还表明,这些免疫细胞(CD8 + T细胞)中的大多数具有中断治疗后导致HIV-1反弹的HIV感染细胞的能力。这种见解可以有助于开发新的针对HIV感染的治疗策略。
ART已将HIV-1从致命疾病转变为可控的慢性病。但是,感染者必须终生服用,因为中断治疗通常会使病毒在几周内反弹。这种反弹是由携带整合到人类基因组中的HIV-1 DNA的细胞引起的。
7.eLife:有史以来深入分析HIV感染者体内的潜伏病毒库
doi:10.7554/eLife.60933
潜伏病毒库(latent reservoir)是HIV病毒抵抗治疗的最后堡垒。但它很难被摧毁,这是因为它是看不见的:潜伏病毒库中的细胞携带着休眠的HIV,因此它们的表面没有任何病毒蛋白,这就不会泄露它们的身份。为了找到潜伏病毒库细胞,科学家们必须通过激活从感染者身上收集的细胞来重新唤醒这种病毒。一旦被唤醒,这种病毒就会在宿主细胞的表面上产生起着标志物作用的蛋白,这就给人们提供了寻找和研究这些细胞的把柄。然而,重新激活这种病毒的过程本身就会导致细胞生物学的变化,而这些变化会掩盖它们原本的身份。所以,构成潜伏病毒库的细胞--也被称为潜伏感染细胞--的真实身份一直难以捉摸。
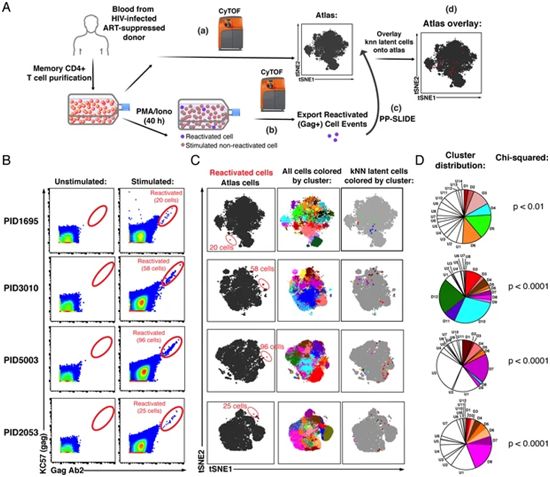
图片来自eLife, 2020, doi:10.7554/eLife.60933。
为了克服这个问题,在一项新的研究中,美国格拉斯通研究所研究员Nadia Roan博士利用她之前开发的一种方法,将重新激活的潜伏病毒库细胞回溯到它们最初的潜伏状态。通过这种方法,Roan和她的团队绘制出了8名HIV感染者的潜伏病毒库细胞图谱。相关研究结果于2020年9月29日发表在eLife期刊上,论文标题为“Phenotypic analysis of the unstimulated in vivo HIV CD4 T cell reservoir”。
Roan说,“我们的研究结果挑战了之前对潜伏病毒库构成作出的一些假设。此外,我们详细的潜伏病毒库细胞图谱将使得我们更容易在感染者中找到这些细胞,这将从根本上改变对潜伏病毒库的研究方式。”
8.Nat Commun:服用治疗HIV和乙肝的NRTI药物或可预防糖尿病
doi:10.1038/s41467-020-18528-z
在一项新的研究中,来自美国弗吉尼亚大学医学院等研究机构的研究人员指出,一组用于治疗HIV和乙型肝炎的药物可能经重新利用后用于预防2型糖尿病。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Repurposing anti-inflammasome NRTIs for improving insulin sensitivity and reducing type 2 diabetes development”。
这些研究人员发现,服用这些药物的患者患糖尿病的风险降低了33%。他们表示,基于这些药物的工作原理,这种风险降低是有意义的,并指出其中的一种称为拉米夫定(lamivudine)的药物显著提高了人细胞样本和糖尿病小鼠模型的胰岛素敏感性。(在2型糖尿病中,身体失去了利用胰岛素有效控制血糖的能力。)(生物谷 Bioon.com)
