CAR-T细胞疗法是近年来一种备受关注的癌症免疫疗法,通过对T细胞进行基因工程改造,使其靶向清除特定癌细胞。基于这一原理,CAR-T细胞也可以被改造用于识别和清除表达HIV-1病毒包膜糖蛋白(Env)的人类T细胞,从而用于治疗艾滋病。然而,迄今为止,还没有一种抗HIV-1 CAR-T细胞能够长期预防ART停药后的病毒反弹。这种无效的一个可能解释是出现了逃逸变异体,在接受单次抗HIV-1 CAR-T细胞治疗的HIV患者中观察到逃逸变异体。因此,扩大CAR识别以抑制病毒逃逸,并使其靶向病毒储库,可能是开发用于治愈艾滋病的抗HIV-1 CAR-T细胞疗法的关键。
近日,复旦大学上海公共卫生临床中心徐建青研究员、张晓燕研究员、张仁芳主任医师,第四军医大学唐都医院孙永涛教授、广西中医药大学冷静教授等在 Cell Discovery 期刊发表了题为:Efficacy and safety of novel multifunctional M10 CAR-T cells in HIV-1-infected patients: a phase I, multicenter, single-arm, open-label study 的研究论文。
该研究开发了一种具有三重功能的CAR-T细胞疗法——M10 CAR-T细胞疗法,包括对HIV-1感染细胞的广泛细胞毒性作用,中和潜伏其逆转后产生的游离病毒,以及B细胞滤泡归巢。研究团队还在18名HIV-1病毒感染者中进行了临床试验,结果显示,该CAR-T细胞疗法显著降低了患者的HIV-1 RNA水平,这些数据支持M10 CAR-T细胞作为治疗艾滋病感染者的新疗法的潜力。

联合广泛中和抗体(bNAb)是增强抗HIV-1 CAR-T细胞功能的一种有趣策略。CAR的作用依赖于识别表面表达的HIV-1病毒包膜糖蛋白(Env)表位,而bNAb可以通过直接阻断游离病毒与宿主细胞的结合来中和游离病毒,并通过与Fc受体结合来增强HIV-1特异性免疫应答。然而,对于这种二合一疗法应用于HIV感染者是否能提高疗效,目前尚无探索。
另一方面,抗HIV-1 CAR-T细胞在体内表现的一个关键决定因素是它们的组织分布,更有效和更广泛的靶向病毒储库会带来更好的疗效。B细胞滤泡已被确定为慢性HIV-1感染期间潜伏和活性HIV-1的免疫特权避难所。研究表明,HIV-1特异性细胞毒性淋巴细在淋巴滤泡内累积失败是病毒持续复制的基础。趋化因子受体CXCR5被认为是驱动淋巴细胞迁移到B细胞滤泡的关键因素。与CXCR5的这一指导作用一致,在非人灵长类动物模型中,表达CXCR5的HIV-1特异性T细胞具有强大的抗病毒活性,这表明靶向B细胞滤泡是开发更有效的抗HIV CAR-T细胞疗法的一种有前景的策略。
在这项最新研究中,研究团队将上述策略结合在一起,开发了一种具有三重功能的CAR-T细胞,这是一种携带内源性广泛中和抗体(bNAb)和滤泡归巢受体CXCR5的抗HIV-1 CAR-T细胞,研究团队将其称为M10细胞。M10细胞被设计为具有三重生物学功能,包括对HIV-1感染细胞的广泛细胞毒性作用,中和潜伏其逆转后产生的游离病毒,以及B细胞滤泡归巢。
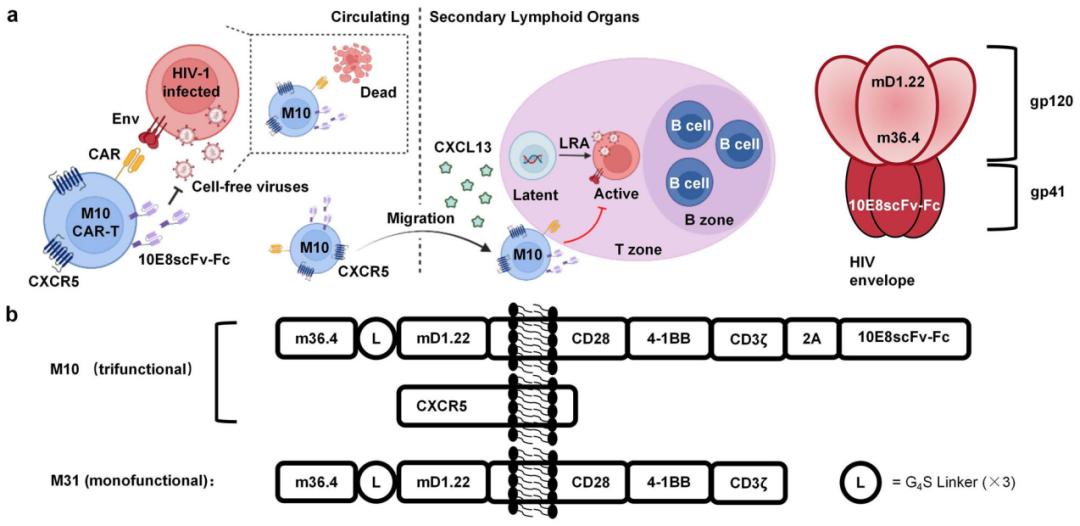
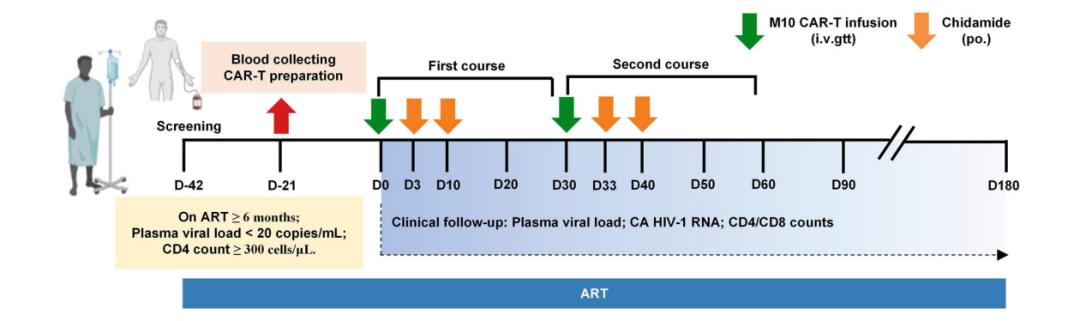
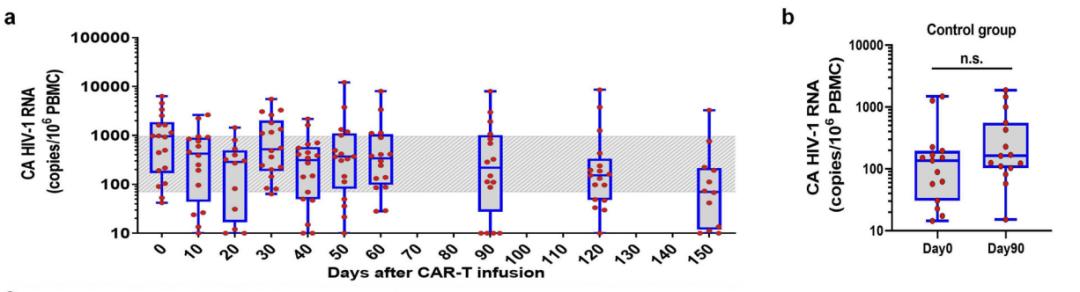
在证明了M10细胞的这种三重功能后,研究团队开展了一项针对HIV-1感染者的1期、多中心、单臂、开放标签的人体临床试验,共18名HIV-1感染者接受了间隔30天两次输注同种异体M10 细胞,每次输注M10细胞后,进行两次西达本胺刺激,以激活患者体内的HIV-1储存库,M10细胞输入显著抑制了HIV-1病毒反弹,将血浆中HIV-1病毒滴度峰值降低了74.3%,病毒载量平均下降了67.1%,10例患者在15天观察期间显示细胞相关HIV-1 RNA水平持续降低,还发现M10细胞对潜伏的病毒储库施加选择性压力,研究中未观察到明显的治疗相关不良反应。
总的来说,该研究支持了M10 CAR-T细胞作为一种新型、安全、有效的功能性治愈HIV-1感染或艾滋病的治疗选择的潜力。
